 药动量
药动量
- 通知1:中国药品销售数据已更新至2023年8月
- 通知2:美国药品销售数据已更新至2022全年
2024药物预测礼来辉瑞第一三共
来源:药动量 | 2024-02-02


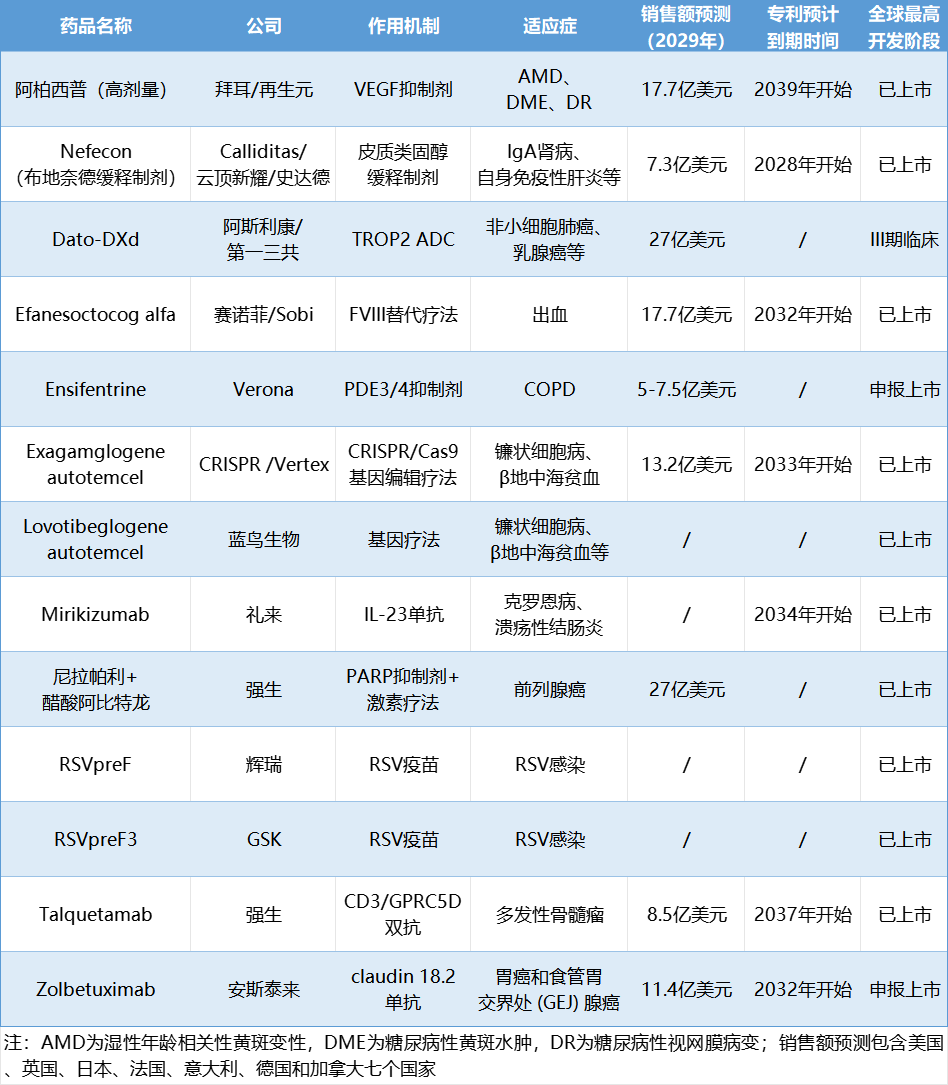
2024年最值得关注的药物包括:
阿柏西普是一种全人类的重组融合蛋白,由VEGF受体1的第二免疫球蛋白(Ig)结合域和VEGF受体2的第三Ig结合域组成,与人类IgG1的Fc区融合。与其他的抗血管内皮生长因子疗法不同,它除了和所有VEGF-A异构体、VEGF-B,还能够与胎盘生长因子(PlGF)结合。除此之外,阿柏西普的另一个特点是,它对VEGF显示出非常高的亲和力,亲和力(Kd)达到0.5pM,强于雷珠单抗、贝伐单抗以及自身VEGF受体。这意味着阿柏西普即使在低浓度下也能有效阻断VEGF,因此有着更长的作用时间,从而可以延长给药间隔。
结构式:
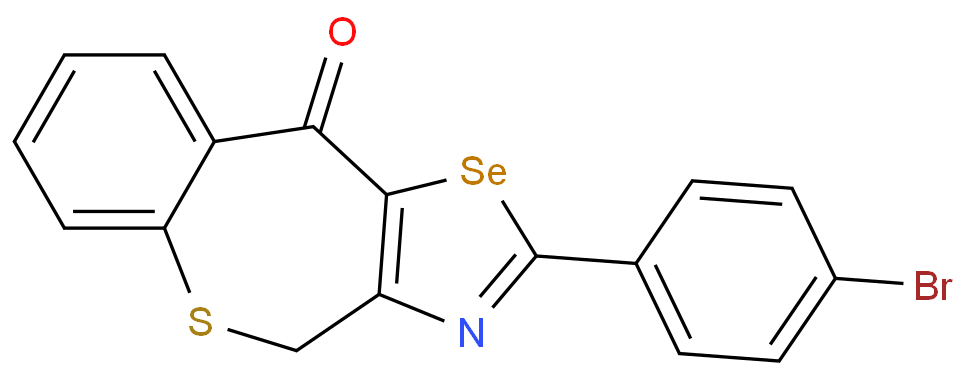
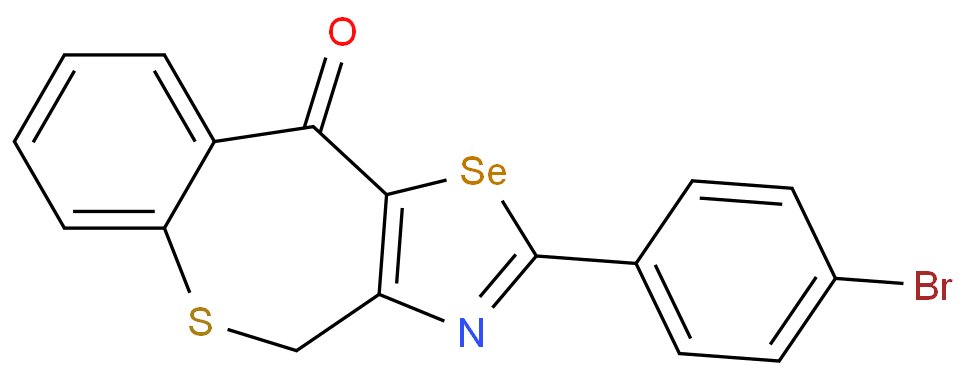
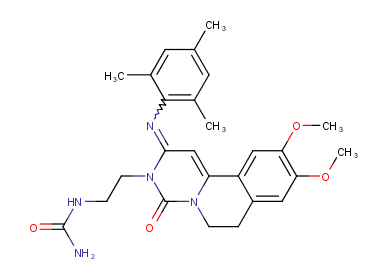
布地奈德是一种糖皮质激素,具有强糖皮质激素活性和弱盐皮质激素活性,首过代谢程度极高;通过覆以肠溶包衣,使Nefecon可以完整无损地到达回肠,靶向作用于回肠末端的黏膜 B 细胞(包括派尔集合淋巴结),从而减少诱发 IgA 肾病的半乳糖缺陷的 IgA1 抗体( Gd-IgA1 )产生。该药物的商品名为Nefecon,是全球首个IgA 肾病的靶向治疗药物,用于具有进展风险的成人原发性 IgA 肾病,降低蛋白尿水平。该药物已于2021年获FDA加速批准上市,于2022年获EMA附条件上市许可批准,于2023年11月获NMPA批准上市,用于治疗具有进展风险的原发性IgA肾病成人患者。
报告表示,与传统皮质类固醇相比,布地奈德缓释制剂在降低原发性免疫球蛋白 A(IgA) 和减缓肾功能下降方面显示出更大的有效性,并且具有更好的安全性特征。因此,该产品可能在高危患者中有高接受度。预计,2029年布地奈德销售额将达到7.3亿美元。
结构式:
化学结构:
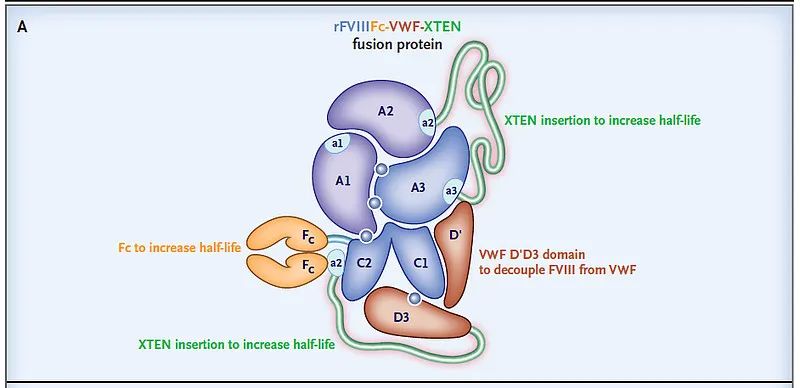
BIVV001结构示意图(图片来源
结构式:
Ensifentrine(恩塞芬汀)是一款磷酸二酯酶蛋白吸入型双靶点PDE 3/4抑制剂,双重抑制机理使其能够凭借单个化合物同时实现支气管扩张和抗炎效应。中性粒细胞炎症是慢性阻塞性肺病(COPD)的最主要作用途径,通常对类固醇治疗应答不理想。Ensifentrine 是一种对中性粒细胞也非常有效的药物,因此这也是该药物能够减少 COPD 主要炎症成分的潜在重要途径。
作为所有新型药物(包括生物制品)中处于最快开发阶段的药物,恩塞芬汀最有可能被用作长效支气管扩张疗法的附加治疗。据科睿唯安推测,2029 年该产品的预期销售额将达到5-7.5亿美元。
结构式:无
Exagamglogene autotemcel(exa-cel,Casgevy)是CRISPR与Vertex 联合研发的体外基因编辑疗法,开发适应症为镰状细胞病 (SCD)和 β-地中海贫血症(TDT)。通过体外基因编辑,研发团队对CD34+ HSPC 细胞中红细胞(erythroid)特异的BCL11A 基因的加强子(enhancer)进行抑制,以此得到改造后的细胞并给患者进行回输。BCL11A蛋白是一种调控因子,通常在出生后抑制胎儿血红蛋白的产生,因此通过BCL11A基因的编辑减少其蛋白产物的合成,可以促进造血干细胞产生更多携带胎儿血红蛋白的红细胞,以逐步取代成人的镰状红细胞。
该药物是全世界首款获批上市的CRISPR基因编辑疗法,据科睿唯安推测,2029 年该产品的预期销售额将达到13.2亿美元。
结构式:无
Lovotibeglogene autotemcel(lovo-cel,Lyfgenia)的工作原理是通过慢病毒载体将β珠蛋白基因的功能拷贝递送至患者的血液干细胞中,以产生常规的红血球蛋白;该药物通过将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能,拷贝添加至患者自身的造血干细胞(HSCs)中,使患者的红细胞产生抗镰状血红蛋白(HbAT87Q),从而降低HbS的比例。
在此之前,镰状细胞病可用的治疗方法很少,唯一的治疗方法是骨髓移植;蓝鸟生物将该产品定价为310万美元。
化学结构:
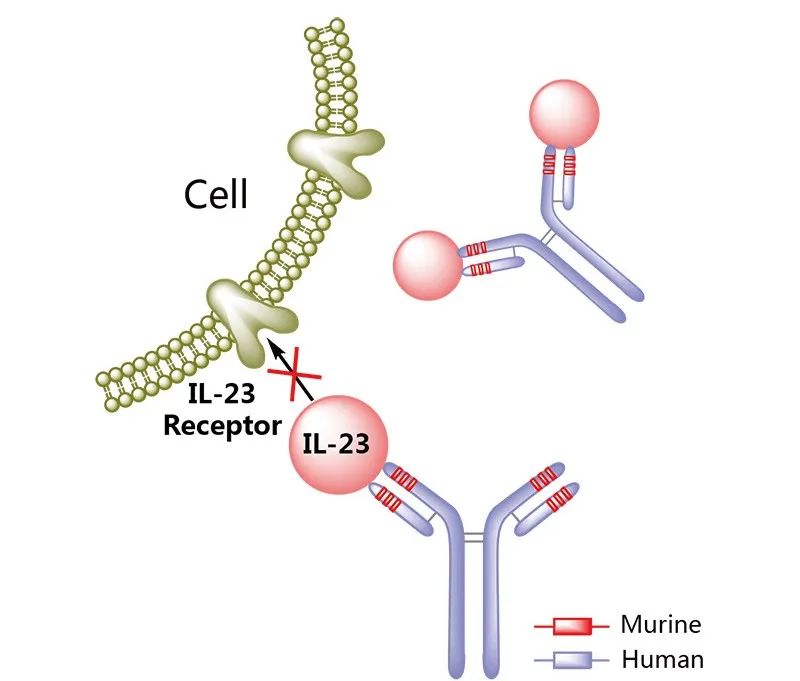
图片来源
Mirikizumab 是一种白细胞介素 23(IL-23)p19 拮抗剂,可与IL-23的p19亚基结合,进而阻断IL-23介导的炎症反应。2023年10月,该药物获FDA批准用于治疗成人中度至重度活动性溃疡性结肠炎(UC);同月,公司宣布,该药物用于治疗患有中度至重度活动性克罗恩病(CD)的成人的VIVID-1研究中达到了共同主要终点和所有主要次要终点,公司计划在 2024 年向FDA提交mirikizumab用于治疗CD的上市申请。
Mirikizumab是首款治疗UC的 IL-23p19 单抗,亦可能成为获批用于治疗CD的第三种药物;此前获批UC的两款IL-23单抗分别是乌司奴单抗和利生奇珠单抗。分析师预测,Mirikizumab将在2028年达到12亿美元的年销售量。
结构式:
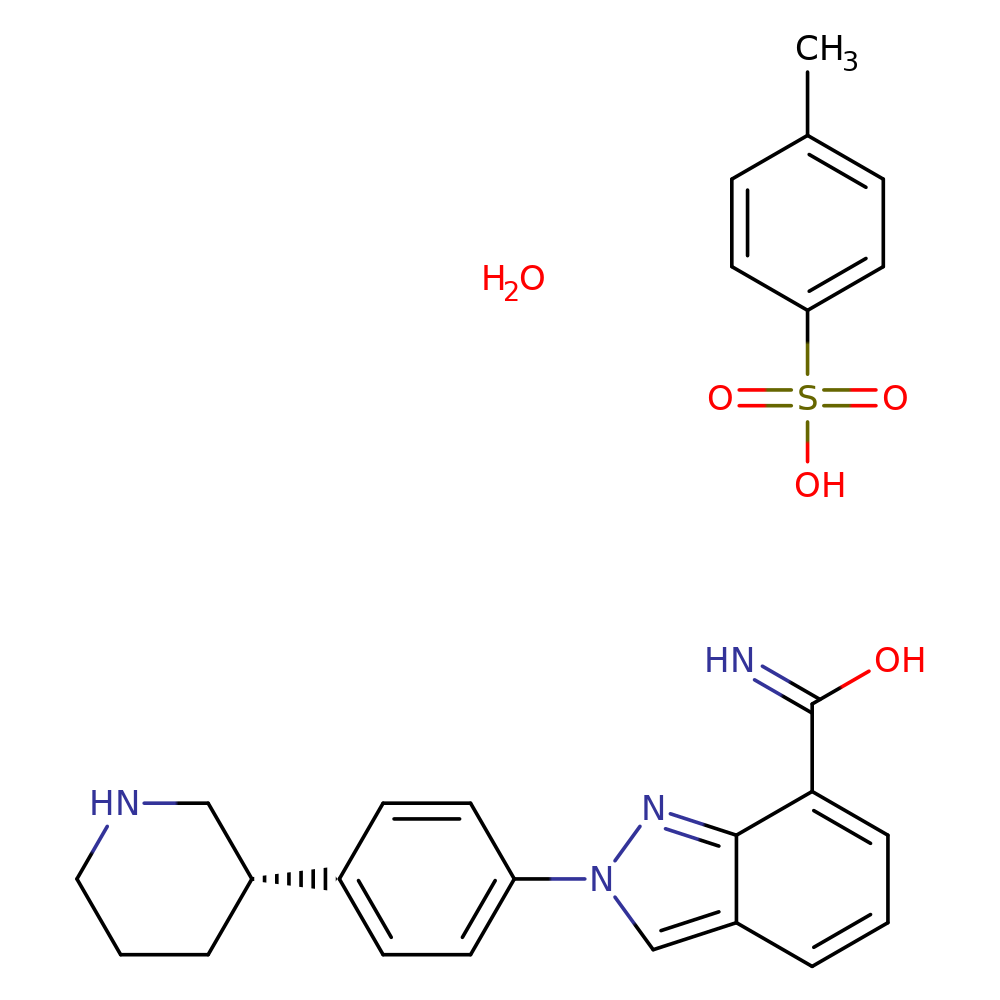
尼拉帕利(niraparib,Zejula)是一种PARP抑制剂,通过抑制PARP酶的活性,使PARP-DNA复合物的形成增加,导致DNA损伤、凋亡和细胞死亡;阿比特龙(abiraterone acetate,Zytiga)是一种CYP17抑制剂,常联合泼尼松用于既往接受多西他赛治疗的转移性去势抵抗性前列腺癌患者。2023年4月,强生旗下杨森制药宣布Akeega获EMA上市许可,这是该药物在全球范围内的首次获批;Akeega是由尼拉帕利和醋酸阿比特龙组合而成的复方片剂。
在mCRPC患者中,通常使用雄激素剥夺疗法来阻断男性性激素的作用,但前列腺癌仍会生长并扩散到身体的其他部位。大约10-20%的晚期前列腺癌男性会在五年内发展为去势抵抗性前列腺癌(CRPC),其中至少有84%的男性在CRPC诊断时会有转移。在CRPC诊断时没有转移的患者中,33%可能在两年内发生转移。大约10%-15%的mCRPC患者携带BRCA1/2基因突变。据科睿唯安推测,2029 年上述复方制剂的预期销售额将达到27亿美元。
结构式:无
RSVpreF(Abrysvo)属于二价呼吸道合胞病毒(RSV)疫苗,通过注射怀孕32 至36 周妇女来实现对出生至6 个月婴儿的RSV 预防。2023 年5 月,辉瑞宣布FDA已批准Abrysvo(PF-06928316)上市,可用于预防60 岁及以上人群出现由RSV 引起的下呼吸道疾病。2023 年8月,该药物的新适应症获批,通过孕妇主动免疫,预防出生至6 个月大的婴儿患上RSV 相关下呼吸道疾病(LRTD),这是FDA 批准的首款保护婴儿在出生至6 个月内免受RSV引起的LRTD 和严重LRTD 的孕产妇接种疫苗。
上市后首个季度,辉瑞实现3.75亿美元的销售额,实现疫苗大单品的快速放量。
结构式:无
RSVpreF3(Arexvy)由RSV融合前(prefusion)F 糖蛋白(RSVPreF3)与GSK 专有的佐剂AS01E组合而成,2023 年5 月,FDA批准Arexvy用于预防60 岁及以上人群因感染RSV 引发的下呼吸道疾病(LRTD),是全球首款突破性获批上市的用于老年人RSV疫苗。
上市后首个季度,GSK实现7.1 亿英镑的销售额,销量超过辉瑞。据科睿唯安推测,未来五年 RSV 疫苗和预防治疗的潜在市场价值为 100 亿美元。
结构式:无
Talquetamab是一款在研的first-in-class现货型双特异性T细胞结合抗体,能同时靶向多发性骨髓瘤(MM)细胞上的GPRC5D和T细胞上的CD3。GPRC5D名为G蛋白偶联孤儿受体,其在恶性浆细胞上过表达,在正常组织的表达仅限于皮肤和睾丸,且其表达水平与BCMA靶点相对独立。该药物通过激活CD3阳性T细胞,诱导T细胞对GPRC5D阳性MM细胞进行杀伤。
化学结构:
图片来源
转移性 HER2 阴性胃癌和GEJ腺癌对新的有效治疗方法的巨大需求明显未得到满足。zolbetuximab 有望成为进入肿瘤市场的首个 CLDN18.2 抑制剂,为转移性HER2阴性胃或 GEJ 腺癌的一线治疗提供急需的生物标志物驱动选择。据科睿唯安推测,2029 年该药物的预期销售额将达到11.4亿美元。
如需下载报告,请点击《2024年最值得关注的药物预测》
展望未来 | 2024年最值得关注的13款药物预测!(附报告下载)
2024-02-02重磅!辉瑞BCMA/CD3双抗【Elranatamab】在华申报上市!拟纳入优先审评!
2024-01-31百亿市场!3亿畅销降压药!赛默制药【盐酸贝尼地平片】申报上市
2024-01-30
微信扫一扫联系
客服

微信扫一扫关注
公众号