 药动量
药动量
- 通知1:中国药品销售数据已更新至2023年8月
- 通知2:美国药品销售数据已更新至2022全年
正大天晴奥贝胆酸片
来源:药动量 | 2024-02-01

2月1日,中国国家药监局药品审评中心(CDE)官网公示,正大天晴药业集团股份有限公司递交了【奥贝胆酸片】的上市申请,同日已获得受理。

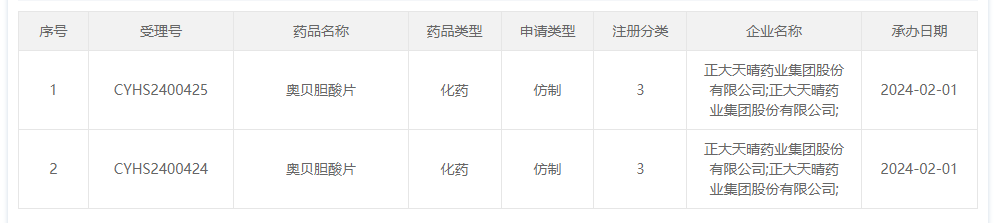
截图来源:CDE官网
奥贝胆酸(Obeticholic Acid,OCA。商品名 Ocaliva)是属于法尼酯X受体(以下简称“FXR”)的强效激动剂。FXR是一种在肝脏和肠道中高水平表达的核受体,在胆酸代谢调节中起关键性作用。该药可通过活化法尼醇X受体,间接抑制细胞色素7A1(CYP7A1)的基因表达,增强FGF-19的表达。奥贝胆酸是二十年来首个研发用于治疗胆汁淤积性肝病的药物,可抑制胆酸合成,用于治疗原发性胆汁性肝硬化(PBC)、非酒精性脂肪性肝病(NASH)、原发性硬化性胆管炎。

奥贝胆酸由美国Intercept 制药公司研发,2016年5月27日,奥贝胆酸获得美国 FDA 批准上市,用于治疗原发性胆汁性肝硬化。2016 年 12 月,奥贝胆酸获得欧盟批准上市,后陆续在加拿大、澳大利亚等国家获批上市。另外奥贝胆酸还于2010年获得欧洲药品管理局孤儿药委员会(COMP)的孤儿药资格认定。孟加拉碧康制药生产的Obetix是奥贝胆酸全球首仿药,也是迄今为止唯一获得政府监管机构批准合法生产的仿制药。
自上市以来,奥贝胆酸在全球销售额呈现不断增长态势,获批上市后首年销售额约1800万美元,2018年就达到约1.78亿美元,增长近10倍,2019年奥贝胆酸销售额为2.5亿美元, 2020年奥贝胆酸全球销售额已达到3.1亿美元,同比增长24.8%。目前原研厂家的产品还未在国内上市。
Intercept奥贝胆酸2020年前三季度销售额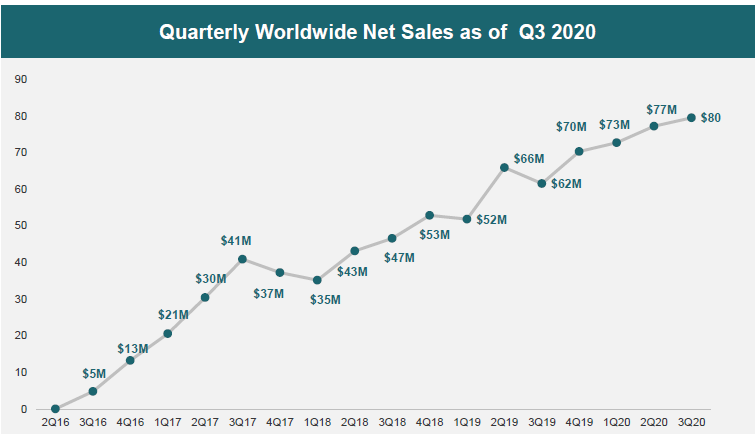
国内布局奥贝胆酸片的药企不少,包括正大天晴、江苏恒瑞、上海复旦张江、华润三九、成都倍特、扬子江药业、四川科伦、苏州泽璟生物等。2021年3月,奥贝胆酸入选我国第二批鼓励仿制药品目录。此前正大天晴和恒瑞医药进展最快,先后递交了上市申请,均未通过。泰州复旦张江、扬子江药业、四川科伦药业和成都倍特药业等多家企业都已获准开展临床。
奥贝胆酸片仿制信息汇总
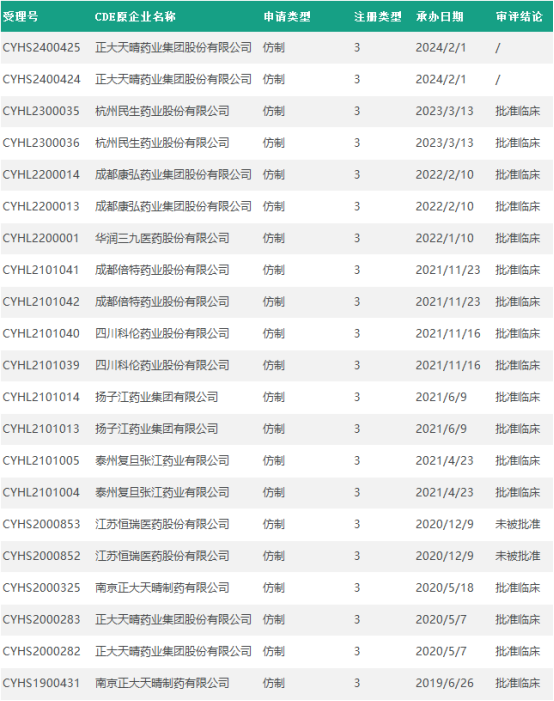
制图:药动量
在 2019 年 6 月,南京正大天晴曾经以 3 类递交奥贝胆酸片的上市申请,但最终获得临床默示许可,适应症为联合熊去氧胆酸(ursodeoxycholicacid,UDCA)用于对 UDCA 反应不足的成人原发性胆汁性胆管炎(PBC)患者,或作为单一疗法用于对 UDCA 不耐受的成人原发性胆汁性胆管炎患者的治疗。
原发性胆汁性胆管炎(PBC),又称原发性胆汁性肝硬化,发病率 3.3-5.8/百万人,患病率是 19-402/百万人,属于一种罕见病,但患病率逐年增加,曾被 FDA 授予快速通道和孤儿药资质。其是一种肝内胆小管渐进性损伤的慢性疾病,主要是因胆管遭到自身免疫性破坏,导致胆汁淤积。随时间损伤肝细胞,导致肝硬化和肝脏瘢痕形成。当肝硬化进展和肝中瘢痕组织量增加后,肝脏将丧失其功能。
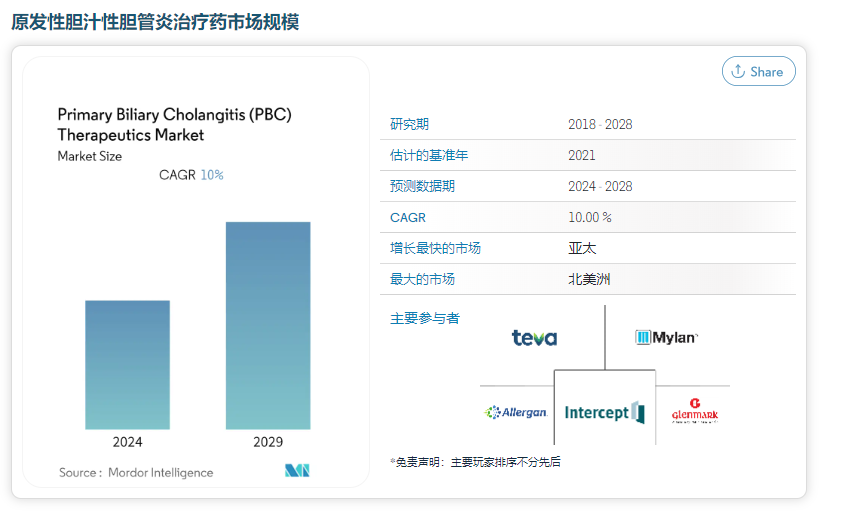
此次正大天晴再次提交【奥贝胆酸片】的上市申请,若顺利获批,将成为国内首仿,为中国患者带来新的希望。2024年,正大天晴能否让【奥贝胆酸片】和整个NASH领域迎来历史性跨越,我们拭目以待!
展望未来 | 2024年最值得关注的13款药物预测!(附报告下载)
2024-02-02重磅!辉瑞BCMA/CD3双抗【Elranatamab】在华申报上市!拟纳入优先审评!
2024-01-31百亿市场!3亿畅销降压药!赛默制药【盐酸贝尼地平片】申报上市
2024-01-30
微信扫一扫联系
客服

微信扫一扫关注
公众号